Notizie
Come si diffonde la resistenza agli antibiotici nelle colonie batteriche
15 agosto 2023 |
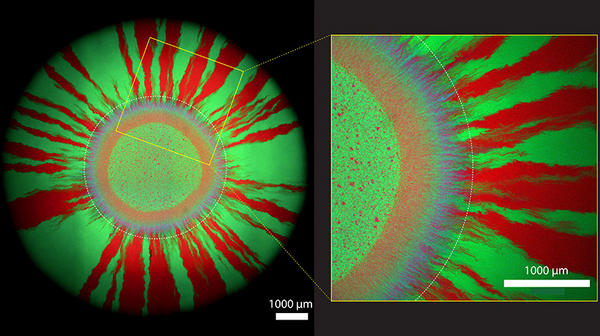
Quelle che a prima vista sembrano opere d'arte, create sotto l'effetto di una generosa dose di sostanze psichedeliche, sono immagini al microscopio di colonie batteriche che crescono su piastre di coltivazione in laboratorio. I colori scintillanti sono dovuti al fatto che i ricercatori del dipartimento di microbiologia ambientale dell'Eawag Water Research Institute hanno dotato diversi ceppi di batteri di diversi geni per le proteine fluorescenti: Alcune cellule si illuminano di rosso, altre di verde.
Elementi genetici mobili per il trasferimento della resistenza agli antibiotici
Inoltre, esiste un altro gene per una proteina fluorescente blu, che Yinyin Ma, Josep Ramoneda e Dave Johnson hanno integrato in un cosiddetto plasmide. I plasmidi (a differenza dei cromosomi, molto più grandi) sono piccoli elementi genetici mobili che i batteri possono scambiarsi tra loro. I plasmidi possono, ad esempio, contenere geni che neutralizzano l'effetto degli antibiotici, conferendo così ai batteri una resistenza a questi agenti altrimenti letali.
"I plasmidi sono il vettore più importante per il trasferimento della resistenza agli antibiotici tra le cellule batteriche", spiega Johnson. Poiché nei loro esperimenti i ricercatori hanno etichettato il plasmide scambiabile in blu, essi rendono visibile ciò che accade nell'ambiente in modo del tutto inosservato: Se i batteri rossi ricevono il plasmide, appaiono magenta. E le cellule verdi assumono un colore turchese quando ricevono un plasmide dalla cellula vicina.
Corona viola incorniciata da raggi rossi e verdi
Il gruppo di Johnson è interessato al modo in cui la resistenza agli antibiotici si diffonde nelle colonie batteriche in crescita. Per i loro esperimenti, i ricercatori hanno applicato piccole gocce di una miscela di batteri magenta e microbi verdi a piastre di coltura prive di antibiotici. "Le colonie batteriche continuano a crescere verso l'esterno", spiega Johnson. Come mostrano le immagini al microscopio che i ricercatori hanno scattato una settimana dopo aver allestito le colture batteriche, un anello viola (composto da cellule di colore magenta e turchese) si forma inizialmente intorno alla minuscola goccia. In questa prima zona di crescita, i batteri scambiano il plasmide più intensamente tra loro.
Più tardi, cioè più lontano, si forma una serie di raggi verdi e rossi. Qui le cellule hanno già perso il plasmide. Questo perché le cellule senza plasmide possono dividersi più rapidamente: Risparmiano l'energia di cui le cellule con il plasmide hanno bisogno per moltiplicare l'elemento genetico aggiuntivo. In altre parole, godono di un vantaggio evolutivo e, pertanto, sono in grado di correre quando non c'è l'antibiotico sulla piastra di riproduzione.
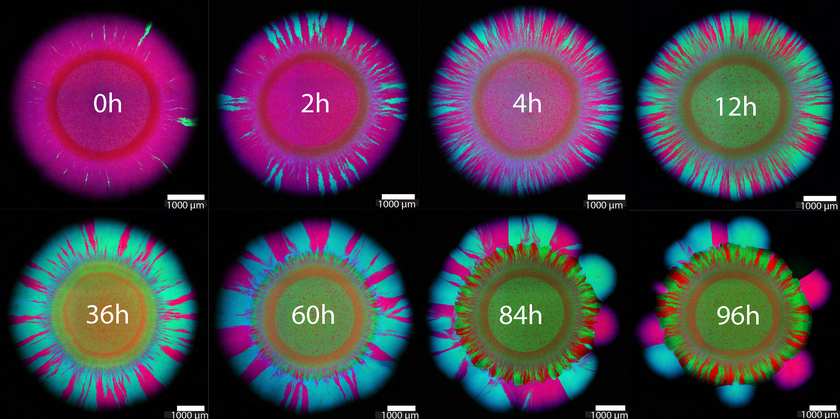
Ma su altre piastre di riproduzione, i ricercatori di Johnson hanno applicato un antibiotico - e in momenti diversi in ciascun caso. Gli schemi colorati completamente diversi suggeriscono che il plasmide viene trasferito maggiormente quando l'antibiotico viene somministrato tra le 10 e le 70 ore dopo l'inizio della crescita. A quanto pare, quindi, l'antibiotico funziona meglio all'inizio o molto più tardi, quando molte cellule hanno già perso il loro plasmide.
A seconda del momento in cui viene aggiunto l'antibiotico, emergono modelli di crescita di colore diverso.
Springer Nature, Timing of antibiotic administration determines the spread of plasmid-encoded antibiotic resistance during microbial range expansion, Yinyin Ma et al, Springer Communications. DOI: https://doi.org/10.1038/s41467-023-39354-z
Importanza crescente a livello globale
Si può anche concludere da questi risultati a che punto si dovrebbero somministrare gli antibiotici ai pazienti umani (o animali)? "No", dice Johnson. È impossibile, dice, perché gli esperimenti in laboratorio possono essere confrontati solo in misura molto limitata con l'uso degli antibiotici in clinica. Perché ci sono molti più di due diversi ceppi di batteri che vivono su e in noi esseri umani e animali. Questo potrebbe essere uno dei motivi per cui le resistenze agli antibiotici rimangono nell'intestino per anni - e non scompaiono come nel piatto da riproduzione.
In ogni caso, ci sono ancora molte domande aperte a cui rispondere. Johnson ha già una serie di idee su quali aspetti vorrebbe approfondire con il suo gruppo. In questo modo, il suo gruppo sta contribuendo passo dopo passo a una conoscenza più approfondita dello scambio genetico tra batteri. I ricercatori sono consapevoli che tale conoscenza è sempre più importante a livello globale: "Crediamo che una migliore comprensione temporale dell'interazione tra trasmissione e perdita di plasmidi in comunità microbiche complesse sia essenziale per affrontare meglio la crisi globale della resistenza agli antibiotici", affermano alla fine del documento tecnico recentemente pubblicato.
Pubblicazione originale
Foto di copertina: Schema di crescita colorato: i batteri incandescenti possono essere visti quando scambiano materiale genetico l'uno con l'altro.
(Copyright: Springer Nature, Timing of antibiotic administration determines the spread of plasmid-encoded antibiotic resistance during microbial range expansion, Yinyin Ma et al, Springer Communications)