News
Mikrobielle Biodiversität ist komplexer als gedacht
2. Juni 2021 |
Darmbakterien sind wichtig, denn sie helfen uns bei der Verdauung. Und sie schützen uns vor krankmachenden Keimen: Diese müssen es zuerst mit dieser Armee von «guten» Mikroben aufnehmen, um uns zu infizieren. Je diverser diese Armee, also je mehr unterschiedliche Arten sie enthält, desto schwieriger ist es für die Krankheitserreger sich einzunisten. Die mikrobielle Biodiversität ist aber auch in anderen Zusammenhängen wichtig. So kann sie zum Beispiel Aussagen darüber machen, wie wahrscheinlich es ist, dass mikrobielle Gemeinschaften in Kläranlagen bestimmte Schadstoffe abbauen können.
Doch mikrobielle Biodiversität ist mehr als nur die Anzahl und Häufigkeit verschiedener Arten. Zu diesem Schluss kommt ein Forscherteam um David Johnson vom Wasserforschungsinstitut Eawag. Demnach hängt die Biodiversität einer mikrobiellen Gemeinschaft nicht nur von der Diversität der Arten ab, sondern auch von der Diversität der räumlichen Muster, welche die Arten formen. Solche Muster entstehen nach dem Prinzip der Selbstorganisation, wenn verschiedene Arten zusammen wachsen und sich im Raum ausbreiten.
Es muss noch einen weiteren Faktor geben
Bisher ging die Forschung davon aus, dass die Form der Muster vor allem durch zwei Faktoren bestimmt wird. Die genetischen Besonderheiten der verschiedenen Arten, zum einen, und die wachstumsbestimmenden Umweltbedingungen, zum anderen. Als Johnson und sein Team diese Annahme genauer untersuchten, stiessen sie aber auf eine Überraschung: Sie entdeckten unterschiedliche Wachstumsmuster, obwohl sie Genetik und Wachstumsbedingungen für zwei verschiedenen Bakterienstämme konstant hielten. Es musste also noch einen weiteren Faktor geben, der die Form der Muster bestimmte.
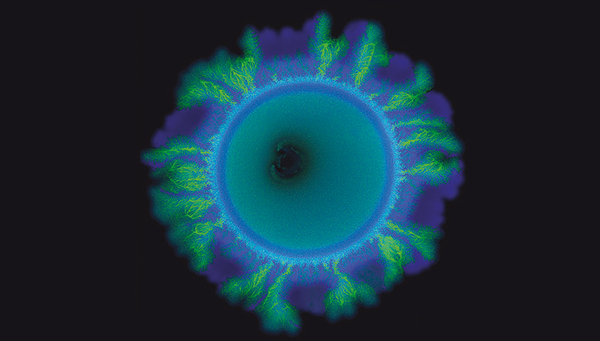
Für ihr Experiment stellten die Forschenden im Labor zwei Stämme des Bodenbakteriums Pseudomonas stutzeri her. Diese waren genetisch so gut wie identisch und unterschieden sich in nur einem einzigen Gen. Dieses entschied darüber, ob ein Stamm ein Produzent oder ein Konsument des Moleküls Nitrit war. Der Bakterienstamm, der Nitrit produzierte erschien unter dem Mikroskop blau, der Stamm, der Nitrit konsumierte, erschienen grün.
Als die Forschenden diese zwei Stämme im Verhältnis eins-zu-eins mischten und das Gemisch gleichmässig auf einer Oberfläche verteilten, erwarteten sie auch ein gleichmässiges Wachstum. Zum Beispiel eine zusammenhängende äussere Schicht aus dem zuerst wachsenden blauen Produzentenstamm, gefolgt von einer inneren Schicht aus dem später wachsenden grünen Konsumentenstamm.
Grüne verzweigte Muster durchsetzt von blauen Stellen
Doch die Forschenden sahen etwas ganz Anderes. Der grüne Stamm wuchs in verschlungenen, verzweigten Mustern, unregelmässig durchsetzt von Stellen gleichförmigen Wachstums des blauen Stamms. «Wir hatten nicht erwartet, dass sich diese beiden unterschiedlichen räumlichen Muster gleichzeitig bildeten», sagt Johnson. Er und sein Team brauchten etwa acht Jahre, um herauszufinden, was da vor sich ging. Zuerst dachten sie, dass sich beide Stämme genetisch auseinanderentwickelt hatten. Doch nach Auswertung unzähliger bakterieller Sequenzen, konnten sie dies als Ursache ausschliessen.
Was also konnte die Muster erklären? Die Antwort lautete: Der Zufall. Wenn eine Mischung von Zellen – in diesem Fall die zwei im Verhältnis eins-zu-eins gemischten Stämme – auf einer Oberfläche verteilt wird, dann ordnen sich die Zellen ungleichmässig an. Das heisst, die Abstände zwischen ihnen sind nicht immer gleich. Stattdessen können sie rein zufällig in Klumpen zusammenkommen. Dies wird als «Poisson-Clumping» bezeichnet und führt zu den unterschiedlichen Mustern, die Johnson und seine Kollegen beobachteten.
Es ist reine Physik
Im experimentellen System der Forscher funktioniert das etwa so: Wenn eine blaue Produzenten-Zelle zunächst hinter einem Klumpen grüner Zellen zu liegen kommt, stösst die blaue Zelle beim Wachsen auf eine physische Barriere aus grünen Zellen. Die blauen Zellen schieben den Klumpen grüner Zellen vor sich her und lassen sie schliesslich zu den baumartigen Mustern wachsen, welche die Forscher beobachtet haben. «Die Diversifikation der Muster hatte nichts mit neuen genetischen Veränderungen oder Heterogenität in ihrer Wachstumsumgebung zu tun», sagt Johnson. «Es ist reine Physik. Mechanische Kräfte, die auf ursprünglich zufällig verteilte Zellen einwirken, rufen die Musterdiversifikation hervor.»
Die Forschenden konnten die Diversifikation der Muster sogar mithilfe mathematischer Simulationen vorhersagen. Als sie ihr mathematisches Modell mit unterschiedlichen Verhältnissen von blauen und grünen Zellen fütterten, sagte der Computer Muster voraus, die dem Wachstum der Bakterien in der Realität entsprachen.
Doch nicht so einfach wie Legos
«Ich hatte mir mikrobielle Gemeinschaften immer als Lego-Sets vorgestellt», sagt Johnson. Wenn man die verschiedenen Teile hat – also die verschiedenen Arten von Mikroben – und die Gebrauchsanweisung – also die Information darüber, wie sie unter einer Reihe von Umweltbedingungen miteinander interagieren –, dann kennt man die Form des zusammengesetzten Lego-Spielzeugs – also die räumliche Anordnung der verschiedenen Arten. «Aber mikrobielle Gemeinschaften sind doch nicht so einfach wie Legos. Eine Gebrauchsanweisung kann ganz verschiedene Spielzeuge ergeben.»
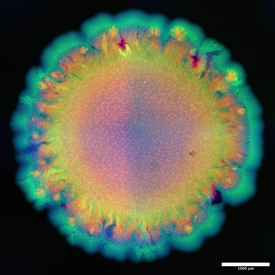
Johnsons Faszination für die Schönheit dieser komplexen Muster zeigt sich in den farbenfrohen Bildern, die sein Büro schmücken. Sie zeigen Mikroskopaufnahmen der mikrobiellen Verzweigungen und Netzwerke in leuchtenden Farben.
Die Tatsache, dass diese Muster nicht nur schön anzusehen sind, sondern auch eine ganz neue Form der Biodiversität darstellen könnten, hat auch praktische Konsequenzen. Denn verschiedene Muster statten eine mikrobielle Gemeinschaft auch mit verschiedenen Eigenschaften aus. Eine solche Eigenschaft ist beispielsweise die Fähigkeit Antibiotika-Resistenzgene auf verschiedenen Arten und Stämme einer Gemeinschaft zu übertragen. Solche Resistenzgene werden oft über Abfälle aus der Landwirtschaft in die Böden einbracht. Dort können sie von räumlich organisierten Bakteriengemeinschaften aufgenommen und weitergegeben werden. Wie gut dieser Prozess funktioniert, könnte von der Vielfalt der räumlichen Muster abhängen und wird derzeit in Johnsons Labor untersucht.
Mikroskopische Aufnahme die zeigt, wie sich Antibiotikaresistenzgene in Abhängigkeit von der räumlichen Anordnung ausbreiten. Gelben Bakterien (mit Antibiotikaresistenz) und blaue Bakterien (ohne Antibiotikaresistenz) wachsen zu räumlichen Mustern und verlieren dabei entweder die Resistenz (rot) oder erwerben sie (grün). Foto: Yinyin Ma, ETH Zürich / Eawag
Titelbild: Yinyin Ma, ETH Zürich, Eawag