News
Sporen archivieren Antibiotikaresistenz
20. Juni 2018 |
Sind die Lebensbedingungen von Bakterien ungünstig, bilden einige Arten Sporen, die lange Zeit auch unter harschen Konditionen überleben und an entfernte Orte verfrachtet werden können. Selbst stundenlanges Abkochen kann ihnen nichts anhaben. Bessern sich die Umweltbedingungen, erwachen die Sporen und werden wieder zu lebenden Bakterien, die sich teilen und vermehren. Ob sich über solche Dauerformen von Bakterien auch Antibiotikaresistenzen konservieren und ausbreiten können, untersuchten Forschende der Eawag und der Universität Neuenburg. Sie haben Bakteriensporen aus Sedimentbohrkernen im Genfersee extrahiert und auf Antibiotika-Resistenzgene untersucht. «Wir fanden im Sediment ein eigentliches Archiv von Resistenzgenen», erzählt Helmut Bürgmann von der Eawag.
Resistenzgene in Sporen spiegeln Antibiotika-Gebrauch
Da sich auf dem Seegrund Jahr für Jahr Biomasse und Partikel ablagern, kann man in einem Sedimentbohrkern die verschiedenen Schichten nach Jahren oder Zeiträumen datieren. Je tiefer man gräbt, desto länger liegt die Ablagerung zurück. Die Forschenden nutzten für ihre Analysen zwei Bohrkerne, die Sedimentablagerungen der letzten 100 Jahre umfassen. Aus verschiedenen Schichten des Bohrkerns extrahierten sie mit einer von der Assistenzprofessorin Pilar Junier an der Universität Neuenburg entwickelten Methode Sporen und Bakterienzellen. Anschliessend bestimmten sie die Anzahl Kopien von Genen, die Resistenzen gegen zwei häufige Antibiotika codieren – Tetracyclin und Sulfonamid. Erwartungsgemäss zeigte sich, dass in den lebenden Bakterienzellen die Entwicklungsgeschichte der Resistenzgene kaum konserviert wird, da sie im Sediment in kurzer Zeit absterben. In Sporen hingegen bleiben die Resistenzgene über Jahre erhalten. «Das Auftreten resistenter Sporen zeigt im zeitlichen Verlauf eine hohe Korrelation mit dem Einsatz der Antibiotika», erklärt Bürgmann. So manifestierte sich etwa die Einführung des Antibiotikums Tetracyclin in den 1960er-Jahren in einem rapiden Anstieg der Resistenzgene in Bakteriensporen in den entsprechenden Sedimentschichten.
Nebst dem zeitlichen Auftreten von Resistenzen in Bakteriensporen interessierte die Forschenden auch, wie sich diese räumlich ausbreiten. Hierzu nahmen sie in unterschiedlicher Entfernung zur Einleitungsstelle der Abwasserreinigungsanlage (ARA) Vidy bei Lausanne neun Sedimentproben. Wie in früheren Untersuchungen mit Bakterienzellen fanden die Forschenden in der Nähe der ARA am meisten Resistenzgene. «Sporen gelangen über die ARA in den See und lagern sich im Sediment ab», so Bürgmann. Während eine ARA für viele Darmbakterien eine gute Barriere darstellt, können Sporen diese möglicherweise besser passieren.
Darmbakterien als Reservoir
Die Forschenden untersuchten auch, zu welchen Typen von Bakterien die Sporen in den Sedimenten gehören. Dabei stellten sie fest, dass die Häufigkeit von Resistenzgenen gegen Tetracyclin stark mit dem Auftreten von so genannten Firmicutes-Bakterien korrelierte, das sind sporenbildende Bakterien, die im menschlichen Darm vorkommen. Dieses Ergebnis zeigte sich sowohl im Rhonedelta als auch in der Nähe der ARA-Einleitung in der Vidy-Bucht. Besonders dominant waren hier Vertreter der Clostridien, eine Untergruppe der Firmicutes-Bakterien. «Diese Resultate sind ein Hinweis darauf, dass die Magen-Darm-Flora des Menschen ein Reservoir für Antibiotikaresistenz darstellt, die mit den Sporen weit verbreitet wird», so Pilar Junier. Gegen Sulfonamide hingegen waren Sporen vieler unterschiedlicher Bakterienarten gefeit. Dies bestätigt frühere Beobachtungen, dass sich gewisse Resistenzgene von einer Bakterienart zur anderen ausbreiten können. «Aufgrund ihrer Langlebigkeit und der hohen Verbreitungsrate können Bakteriensporen wesentlich zur Verbreitung und zur «Speicherung» von Antibiotikaresistenzen in der Umwelt beitragen», schliesst Bürgmann. Die Wahrscheinlichkeit, dass die Sporen in Seesedimenten wieder zum Leben erwachen, schätzt er allerdings als gering ein.
Publikationen
Madueño, L., Paul, C., Junier, T., Bayrychenko, Z., Filippidou, S., Beck, K., … Junier, P. (2018). A historical legacy of antibiotic utilization on bacterial seed banks in sediments. PeerJ, 2018(1), e4197 (19 pp.). http://doi.org/10.7717/peerj.4197
Paul, Ch., Bayrychenko, Z., Junier, T., Filippidou, S., Beck, K., Bueche, M., Greub, G., Bürgmann, H., Junier, P. (2018). Dissemination of antibiotic resistance genes associated with the sporobiota in sediments impacted by wastewater. PeerJ 6:e4989; DOI 10.7717/peerj.4989
http://doi.org/10.7717/peerj.4989
Ausgezeichnete Publikation
Wie lässt sich die Verbreitung von Antibiotikaresistenzen in der Umwelt verringern? Dazu haben Wissenschaftlerinnen und Wissenschaftler aus der ganzen Welt ihr Wissen in einem Feature zusammengetragen – unter ihnen Helmut Bürgmann von der Eawag. Ihr Artikel «Toward a Comprehensive Strategy to Mitigate Dissemination of Environmental Sources of Antibiotic Resistance» wurde im März von der Zeitschrift Environmental Science and Technology als First Runner-up Feature 2017 ausgezeichnet.
http://doi/10.1021/acs.est.7b03623
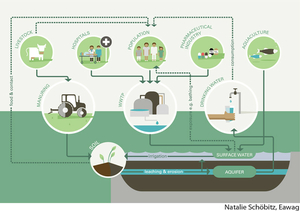
Strategien gegen die Ausbreitung resistenter Keime
Wo landen Antibiotika-resistente Bakterien bzw. die verantwortlichen Gene, die vom Menschen via Fäkalien ausgeschieden werden? Abwasserbehandlungsanlagen spielen hierbei in entwickelten Ländern eine zentrale Rolle. Je nach Sanitätssystem und Wiederverwendung von Fäkalien, Urin und gereinigtem Abwasser bestehen aber noch viele offene Fragen, ob und über welche Wege sich Resistenzen ausbreiten. Forschende verschiedener Institute weltweit, unter ihnen die Eawag, legen in einer Publikation das aktuelle Wissen dar und zeigen auf, wo noch Wissenslücken bestehen. Zudem skizzieren sie, wie der Kampf gegen die Verbreitung von Antibiotikaresistenzen über Sanitätssysteme und Wasser global angegangen werden kann.
Publikation
Helmut Bürgmann, Dominic Frigon, William Gaze, Célia Manaia, Amy Pruden, Andrew C Singer, Barth Smets, Tong Zhang (2018). Water & Sanitation: An Essential Battlefront in the War on Antimicrobial Resistance. FEMS Microbiology Ecology, fiy101 http://doi.org/10.1093/femsec/fiy101
Bilder und Grafiken
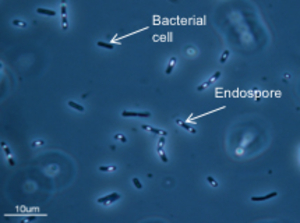
Bakterien mit Endosporen (weisse Körner). Gewisse Bakterien können Sporen bilden und so lange Zeit in unwirtlicher Umgebung überleben und sich verbreiten. (Quelle: Universität Neuenburg)
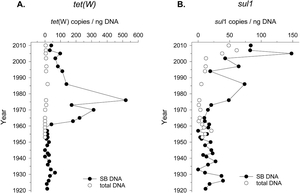
Im Sediment-Bohrkern im Genfersee finden sich Bakteriensporen mit Antibiotikaresistenz-Genen. Ihre Vorkommen stimmt mit dem Gebrauch von Antibiotika in der Vergangenheit überein.
(Quelle: Universität Neuenburg)
Relative Häufigkeit von Antibiotika-Resistenzgenen gegen Tetracyclin und Sulfonamid in Bakterien (total DNA) und Bakterien-Sporen in zeitlich datierten Schichten des Sedimentbohrkerns.
(Quelle: Madueño et al., 2018)
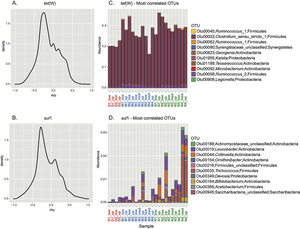
Vorkommen von Sporen unterschiedlicher Bakterientypen korreliert mit dem Auftreten von Resistenzgenen: Tetracyclin-Resistenz kann vor allem Clostridium-Bakterien zugeordnet werden (oben). Sulfonamid-Resistenz korreliert mit unterschiedlichen Bakteriengruppen (unten). (Quelle: Paul et al., 2018)