Archiv Detail
Zellen, Zylinder und Zukunftsvisionen
23. September 2021 |
«Als ich 2019 an die Eawag kam, habe ich zunächst nicht viel anderes gemacht, als versucht, RNA in Fischzellen reinzuschleusen», erzählt Marina Zoppo, Postdoktorandin am Wasserforschungsinstitut Eawag. RNA ist ein Molekül in biologischen Zellen, das in unterschiedlichen Formen vorkommt. Die Molekularbiologin spricht an dieser Stelle von der sogenannten Guide-RNA. Deren Besonderheit ist, dass sie ein wichtiger Bestandteil des sogenannten CRISPR/Cas9-Systems ist. Diese molekularbiologische Technik revolutioniert seit einigen Jahren die Biologie und Medizin und brachte ihren Erfinderinnen Jennifer Doudna und Emmanuelle Charpentier 2020 den Nobelpreis für Chemie ein. Das Besondere daran: Mit dieser «Genschere» können Gene viel schneller und effizienter verändert werden als mit allen bis dahin bekannten Techniken.
Wie funktioniert CRISPR/Cas9
CRISPR steht für «Clustered Regularly Interspaced Short Palindromic Repeats» - das sind bestimmte Abschnitte im Genom von Bakterien, die sich mehrmals wiederholen. Cas9 ist ein Protein ebendieser Bakterien. Zusammen bilden die CRISPR-Abschnitte und Cas9 einen Abwehrmechanismus der Bakterien gegen Viren. Und der funktioniert so: Bei einer Infektion spaltet das Cas9-Protein die DNA der eingedrungenen Viren in kleine Sequenzen. Diese werden dann zwischen die CRISPR-Abschnitte des Bakterien-Genoms eingefügt. Befällt der gleiche Virus die Zelle erneut, kann er dank dieser DNA-Fragmente schnell erkannt und abgewehrt werden.
In der Gentechnik nutzt man das System, um bestimmte Gene zielgenau zu mutieren. Man verbindet dabei das Cas9-Protein mit der Guide-RNA. Diese RNA-Sequenz findet die DNA des Zielproteins im Zellkern und bindet daran. Cas9 schneidet dann an dieser Stelle die DNA des Zielorganismus. Dadurch wird das zelleigene Reparatursystem auf den Platz gerufen, welches den Bruch repariert. Weil dies jedoch nicht immer fehlerfrei geschieht, entsteht im Zielgen eine Mutation. Zudem ist es möglich, mit der Guide-RNA zusätzliche Sequenzen in die Zelle zu schmuggeln, die dann ins Zielgen eingebaut werden.
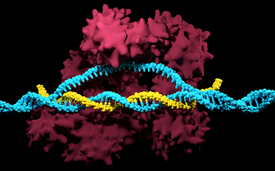
Der CRISPR/Cas9-Komplex mit dem Cas9-Protein (rot), der Guide-RNA (gelb) und der Ziel-DNA (blau).
(Foto: iStock, Meletios Verras)
Das Problem mit der Zellmembran
Während CRISPR/Cas9 für Säugetiere bereits breit angewendet wurde, um genetisch veränderte Zellen herzustellen, gab es für Fische nichts Vergleichbares. Zoppo, die 2018 an der Uni Pisa doktoriert hatte, kam daher mit einem klaren Auftrag an die Abteilung Umwelttoxikologie der Eawag: Die Methode für Fischzellen zu etablieren, insbesondere für die Zellen der Regenbogenforelle.
Die Forscherin brachte einiges an Erfahrung mit der Methode mit an die Eawag. Doch sie erinnert sich: «Ich war etwas überrascht von der erstaunlichen Resistenz der Fischzellen gegenüber Manipulationen. Dies hatte ich vorher bei keiner anderen Zellart vorgefunden». Der Grund dafür ist aber einleuchtend, erläutert die Biologin: Als Kaltwasserfische besitzen Regenbogenforellen eine andere Zusammensetzung der Zellmembran als Säugetiere. Die Zellmembran ist dadurch viel rigider. Zoppo nahm die Herausforderung an, experimentierte mit elektrischen Spannungen und Impulsen, um die richtige Kombination der beiden zu finden, die die Zellmembran durchlässig für die RNA-Moleküle und die Proteine macht (diese Methode nennt sich Elektroporation). Der Erfolg stellte sich schlussendlich ein und die Forscherin konnte die Guide-RNA zusammen mit dem für die Genschere benötigen Cas9-Protein in die Zelle einschleusen. Nur, um dann gleich vor dem nächsten Problem zu stehen.
Das Problem mit den Mutanten
Die Schere hatte also erfolgreich die Zellen geentert und dort ihre Magie entfaltet: Sie hatte zielgenau das von Zoppo ausgewählte Gen im Genom der Regenbogenforelle gefunden, dort die DNA-Sequenz verändert und eine sogenannte Knock-out-Mutation im Gen erzeugt. Das heisst, durch die Mutation in der DNA-Sequenz konnte das Gen jetzt seine übliche Rolle in der Zelle nicht mehr ausführen: Ein hervorragendes Experimentiersystem für die Forscherin, um eben diese Rolle des Gens zu studieren. «Wir beobachten, was passiert, wenn ein Rädchen im System ausfällt. Auf diese Weise lassen sich bisher wenig verstandene Genfunktionen aufklären», erklärt Zoppo.
Nur gab es dabei ein kleines Problem: Es gehört zu den Eigenschaften des CRISPR/Cas9-Systems, dass sich zwar zielgerichtet ein Gen nach Wunsch mutieren lässt, aber: Die exakte DNA-Sequenz, die dabei entsteht, bildet sich in jeder Zelle zufällig. «Weil wir für das Experiment mehrere Zellen verwendet hatten, hatte nun jede Zelle ihre eigene DNA-Sequenz» so Zoppo. Die Aufgabe der Forscherin war es nun, daraus eine «Mutterzelle» herauszupicken und zu vermehren, so dass eine Zelllinie von genetisch identischen Tochter-Klonen entstand. «Hier erwiesen sich die Fischzellen aber wiederum als erstaunlich eigenwillig» erzählt Zoppo. «Keine der herkömmlichen und weit verbreiteten Methoden, die ich kannte und ausprobierte, liessen sich hier einsetzen. Es funktionierte einfach nicht», so Zoppo.
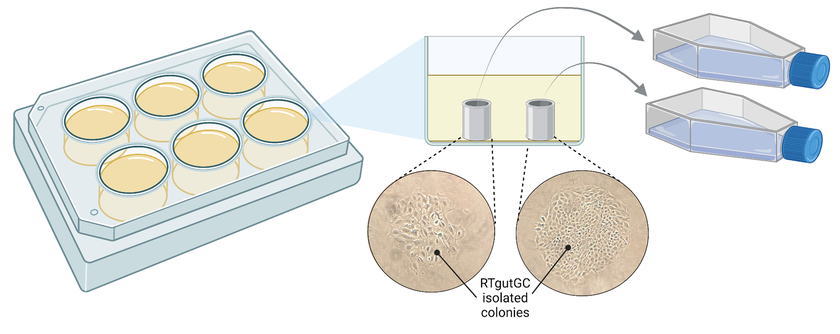
Den Durchbruch brachte schliesslich eine ältere Methode, bei der einfache Klon-Zylinder eingesetzt werden. Wenn sich Zellen in Kultur vermehren, bilden sie Kolonien rund um die Muttervorläuferzelle, welche mit dem Zylinder isoliert und auf eine andere Platte transferiert werden können. «Eigentlich ist es simpel, wenn man erst mal draufgekommen ist», so Zoppo.
Genetisch veränderte Zellen wurden in geringer Dichte in einer Laborplatte mit sechs Vertiefungen ausgesät. Es bildeten sich Kolonien aus genetisch identischen Zellen, die mit Hilfe eines Klon-Zylinder isoliert und in ein grösseres Gefäss übertragen wurden. Abbildung erstellt mit biorender.com.
(Grafik: Eawag, Marina Zoppo)
Warum arbeitet die Eawag mit Fischzelllinien?
Marina Zoppo führte ihre Experimente an der Zelllinie «RTgutGC» durch: Das sind Zellen, die aus dem Darm der Regenbogenforelle gewonnen wurden und als Zelllinie im Labor weitergezüchtet werden. In der toxikologischen Forschung, also, wenn man die schädlichen Effekte von Umwelteinflüssen auf Organismen beobachtet, gewinnen Zelllinien immer mehr an Bedeutung gegenüber Tests mit lebenden Tieren. Einerseits, weil dadurch auf Tierversuche verzichtet werden kann, andererseits, weil die Zelllinien auch konkrete Vorteile haben: Sie ermöglichen die Betrachtung von Prozessen, die bei lebenden Tieren nur schwer zu beobachten sind; und die Tests können einfacher wiederholt und flexibler eingesetzt werden.
In der Umwelttoxikologie untersuchen die Forschenden, ob die Zellen einer genetisch veränderten Zelllinie anders auf bestimmte Chemikalien reagieren als die Zellen des Wildtyps. Dadurch können sie herausfinden, welche Gene bei der Reaktion der Zelle auf die Chemikalie eine Rolle spielen.
Die Zukunft: Screening-Techniken
Mit der von Marina Zoppo etablierten Methode können die Forschenden der Abteilung Umwelttoxikologie nun jedes beliebige Gen der Regenbogenforelle mutieren, um so seine Funktion genauer zu erforschen. «Das ist ein grossartiges neues genetisches Tool. Damit kann ich eine genetisch veränderte Zelllinie in ein paar Wochen erstellen – und das mit grosser Leichtigkeit und Präzision. Mit den herkömmlichen Methoden dauerte dies noch mehrere Monate», sagt die Forscherin.
In Zukunft möchte sie die Technologie miniaturisieren. Sie zeigt Petrischalen mit 24 Einbuchtungen: In jeder Einbuchtung könnte eine andere Guide-RNA eingesetzt werden: Pro Platte könnten also gleichzeitig 24 unterschiedliche Gene verändert werden. «Die Platte wird dann einer Chemikalie ausgesetzt und wir sehen auf einen Blick, welche Mutationen im Zusammenhang mit dieser Chemikalie eine Rolle spielen» erklärt Zoppo ihre Vision. Mit diesem genetischen CRISPR/Cas9-Screening, welches weltweit immer häufiger eingesetzt wird – bisher aber noch nicht mit Fischzellen – werden ökotoxikologische Tests noch schneller und günstiger durchführbar. Es versteht sich von selbst, dass Zoppo die Methode für die Regenbogenforellenzellen etablieren will. Dies könnte es noch etwas dauern, aber sie lässt keinen Zweifel daran, dass sie es schaffen wird.
Titelbild: Eawag, Marina Zoppo