Détail
Cellules, cylindres et visions d’avenir
23 septembre 2021 |
«Lorsque je suis arrivée à l’Eawag en 2019, j’ai commencé par ne faire qu’essayer d’introduire de l'ARN dans des cellules de poisson», raconte Marina Zoppo, post-doctorante à l’Institut de recherche sur l’eau Eawag. L’ARN est une molécule présente sous diverses formes dans les cellules biologiques. La biologiste moléculaire évoque à ce point ce qu’on appelle un ARN guide. Sa particularité est d’être une composante importante du système nommé CRISPR/Cas9. Cette technique de biologie moléculaire révolutionne la biologie et la médecine depuis quelques années et a valu à ses inventrices, Jennifer Doudna et Emmanuelle Charpentier, le Prix Nobel de chimie 2020. Caractéristique particulière: ces «ciseaux génétiques» permettent de modifier les gènes beaucoup plus rapidement et efficacement qu’avec toutes les autres techniques précédemment utilisées.
Comment fonctionne CRISPR/Cas9?
CRISPR est l’acronyme de «Clustered Regularly Interspaced Short Palindromic Repeats» - ce sont certaines séquences dans le génome de bactéries qui se répètent plusieurs fois. Cas9 est une protéine de ces bactéries. Les séquences CRISPR et Cas9 forment ensemble un mécanisme de défense des bactéries contre les virus. Et il fonctionne comme suit: en cas d’infection, la protéine Cas9 divise l’ADN des virus envahisseurs en petites séquences. Celles-ci sont ensuite introduites dans les sections CRISPR du génome de la bactérie. Si le même virus attaque à nouveau la cellule, il peut être rapidement reconnu et combattu grâce à ces fragments d’ADN.
On utilise ce système en technologie génétique pour faire muter certains gènes de manière ciblée. On relie pour cela la protéine Cas9 et l’ARN guide. Cette séquence ARN trouve l’ADN de la protéine cible dans le cœur de la cellule et s’y attache. Cas9 coupe alors l’ADN de l’organisme cible à cet endroit. Le système de réparation de la cellule entre alors en action et répare la cassure. Toutefois, comme cela ne se fait pas toujours sans erreur, une mutation se produit dans le gène cible. Il est en outre possible avec l’ARN guide d’introduire furtivement dans la cellule des séquences supplémentaires qui sont ensuite implantées dans le gène cible.
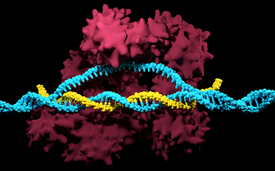
Le complexe CRISPR/Cas9 avec la protéine Cas9 (rouge), l'ARN guide (jaune) et l'ADN cible (bleu).
(Photo: iStock / Meletios Verras)
Le problème de la membrane cellulaire
Alors que CRISPR/Cas9 a déjà largement été utilisé pour les mammifères afin de fabriquer des cellules génétiquement modifiées, il n’existait rien de comparable pour les poissons. Marina Zoppo, qui a présenté sa thèse en 2018 à l’Université de Pise, est arrivée avec une mission claire pour le département de Toxicologie environnementale de l’Eawag: établir la méthode pour les cellules de poissons, en particulier les cellules de la truite arc-en-ciel.
La chercheuse arrivait à l’Eawag avec une bonne expérience de la méthode. Mais elle se souvient: «J’étais un peu surprise de la résistance étonnante des cellules de poissons aux manipulations. Je n’y avais jamais été confrontée avec d’autres types de cellules». Mais la raison est pourtant évidente, explique la biologiste: en tant que poissons d’eau froide, les truites arc-en-ciel possèdent une membrane cellulaire d’une autre composition que celle des mammifères. Leur membrane cellulaire est pour cela beaucoup plus rigide. Marina Zoppo a relevé le défi, expérimenté avec des impulsions et tensions électriques jusqu’à trouver la juste combinaison des deux qui rend la membrane cellulaire perméable aux molécules ARN et aux protéines (cette méthode s’appelle l’électroporation). Le succès fut au rendez-vous et la chercheuse a finalement réussi à introduire dans la cellule l’ARN guide en même temps que la protéine Cas9 nécessaire aux ciseaux génétiques. Mais elle fut immédiatement confrontée au problème suivant.
Le problème des mutants
Les ciseaux avaient donc pris possession des cellules avec succès et déployé leur magie: ils avaient trouvé très exactement le gène choisi par Mme Zoppo dans le génome de la truite arc-en-ciel, où ils avaient modifié la séquence d'ADN et provoqué dans le gène ce qu’on nomme une Knock-out-Mutation. Cela signifie qu’à cause de la mutation dans la séquence d'ADN, le gène ne pouvait plus jouer son rôle attitré dans la cellule: un excellent système d’expérimentation pour la chercheuse afin d’étudier préciseément ce rôle du gène. «Nous observons ce qui se passe lorsqu'un rouage du système fait défaut. De cette manière, les fonctions des gènes jusqu’alors mal connues peuvent être élucidées», explique Mme Zoppo.
Mais il y avait un petit problème: Le système CRISPR/Cas9 a certes la capacité de faire muter un gène choisi de manière ciblée, mais: L’exacte séquence d'ADN alors créée se forme de façon aléatoire dans chaque cellule. «Et parce que nous avions utilisé plusieurs cellules pour l’expérience, chacune d’elles avait à présent sa propre séquence d’ADN», explique Mme Zoppo. À présent, la tâche de la chercheuse était de prélever une «cellule mère» et de la multiplier afin de créer une lignée cellulaire de filles clones génétiquement identiques. «Ici, cependant, les cellules de poissons se sont révélées être étonnamment originales», raconte Mme Zoppo. «Il n’était possible d’utiliser aucune des méthodes largement employées d’ordinaire que je connaissais et avais expérimentées. Cela ne fonctionnait tout simplement pas», dit Mme Zoppo.
La percée est venue d'une méthode plus ancienne utilisant de simples cylindres de clonage. Lorsque des cellules se multiplient en culture, elles forment des colonies autour de la cellule mère précurseur, lesquelles peuvent être isolées avec le cylindre et transférées sur une autre plaque. «En fait, c’est très simple une fois qu’on y a pensé», dit Mme Zoppo.
Des cellules génétiquement modifiées ont été ensemencées à faible densité dans une boîte de laboratoire à six encoches. Des colonies de cellules génétiquement identiques se sont formées. Elles ont été isolées à l'aide d'un cylindre de clonage et transférées dans un vaisseau plus grand. Figure créée à l'aide de biorender.com.
(Graphique: Eawag, Marina Zoppo)
Pourquoi l’Eawag travaille-t-elle sur les lignées cellulaires de poissons?
Marina Zoppo a mené ses expériences sur la lignée cellulaire «RTgutGC»: ce sont les cellules prélevées dans l’intestin des truites arc-en-ciel et cultivées ensuite en laboratoire en tant que lignées cellulaires. Dans la recherche toxicologique, donc, lorsqu’on observe les effets nocifs des conditions environnementales sur les organismes, les lignées cellulaires revêtent une importance accrue par rapport aux tests sur des animaux vivants. Et cela d'une part car on peut renoncer aux expériences sur les animaux et, d’autre part, parce que les lignées cellulaires présentent des avantages concrets: elles permettent d’observer des processus difficilement observables sur des animaux vivants; et les tests peuvent être répétés plus facilement et utilisés de manière plus flexible.
En toxicologie environnementale, les chercheurs examinent si les cellules d’une lignée cellulaire génétiquement modifiée réagissent autrement à certains produits chimiques que les cellules du type sauvage. Cela leur permet de découvrir quels gènes jouent un rôle dans la réaction de la cellule au produit chimique.
L’avenir: Technologies de Screening
Avec la méthode développée par Marina Zoppo, les chercheurs du département Toxicologie environnementale peuvent désormais muter n’importe quel gène de la truite arc-en-ciel pour faire des recherches plus précises sur sa fonction. «C’est un nouvel outil génétique extraordinaire. Il me permet de créer une lignée cellulaire génétiquement modifiée en quelques semaines – avec beaucoup plus de facilité et de précision. Cela durait plusieurs mois avec les méthodes traditionnelles», explique la chercheuse.
Elle aimerait à l’avenir miniaturiser la technologie. Elle montre les boîtes de Pétri avec 24 encoches: Un ARN guide différent pourrait être utilisé pour chaque encoche: il serait alors possible de modifier génétiquement 24 gènes différents simultanément sur chaque plaque. «La plaque est ensuite exposée à un produit chimique et nous voyons immédiatement quelles mutations jouent un rôle en lien avec ce produit chimique», déclare Mme Zoppo pour expliquer sa vision. Avec ce CRISPR/Cas9-Screening, utilisé de plus en plus fréquemment dans le monde entier – mais pas avec des cellules de poisson jusqu’à présent, les tests écotoxicologiques sont réalisables plus rapidement et à moindre frais. Il va de soi que Mme Zoppo veut établir cette méthode pour les cellules de truites arc-en-ciel. Cela pourrait prendre encore un certain temps, mais elle ne doute absolument pas d’y arriver.
Photo de couverture: Eawag / Marina Zoppo


![[Translate to Français:] Genetisch veränderte Zellen wurden in geringer Dichte in einer Laborplatte mit sechs Vertiefungen ausgesät. Es bildeten sich Kolonien aus genetisch identischen Zellen, die mit Hilfe eines Klon-Zylinder isoliert und in ein grös [Translate to Français:] Genetisch veränderte Zellen wurden in geringer Dichte in einer Laborplatte mit sechs Vertiefungen ausgesät. Es bildeten sich Kolonien aus genetisch identischen Zellen, die mit Hilfe eines Klon-Zylinder isoliert und in ein grösseres Gefäss übertragen wurden. Abbildung erstellt mit biorender.com. Grafik: Eawag / Marina Zoppo.](/fileadmin/_processed_/1/0/csm_genetisch_veraenderte_zellen_7732072221.png)